近期,复旦大学丁建东课题组设计并通过微加工制备了具有可拉伸形貌微结构的微流控芯片,在此基础上构建了细胞的准三维黏附状态并进行循环拉伸刺激。通过不同细胞和不同维度的研究表明,准三维微环境介于二维和三维微环境,而且在许多方面,适当的准三维细胞可以模仿三维微环境中的细胞,同时又能像在二维上一样方便地观察。相关成果以标题为“Design and Aligner-assisted Fast Fabrication of a Microfluidic Platform for Quasi-3D Cell Studies on an Elastic Polymer”发表在《Bioactive Materials》。复旦大学高分子科学系、聚合物分子工程国家重点实验室博士后研究员贺迎宁博士为论文第一作者,通讯作者为该国重主任丁建东教授。此研究得到国家自然科学基金等资助支持。
作为体外力学转导的基础研究模型体系,二维细胞拉伸研究相对容易,而三维细胞拉伸模拟了细胞在体内的部分状态,可能对生物医学和生物材料研究产生更重要的影响。因此需要建立一个准三维体外研究模型(图1),它既可以在一定程度上模拟细胞的三维行为,又借助二维模式的简单和便利。
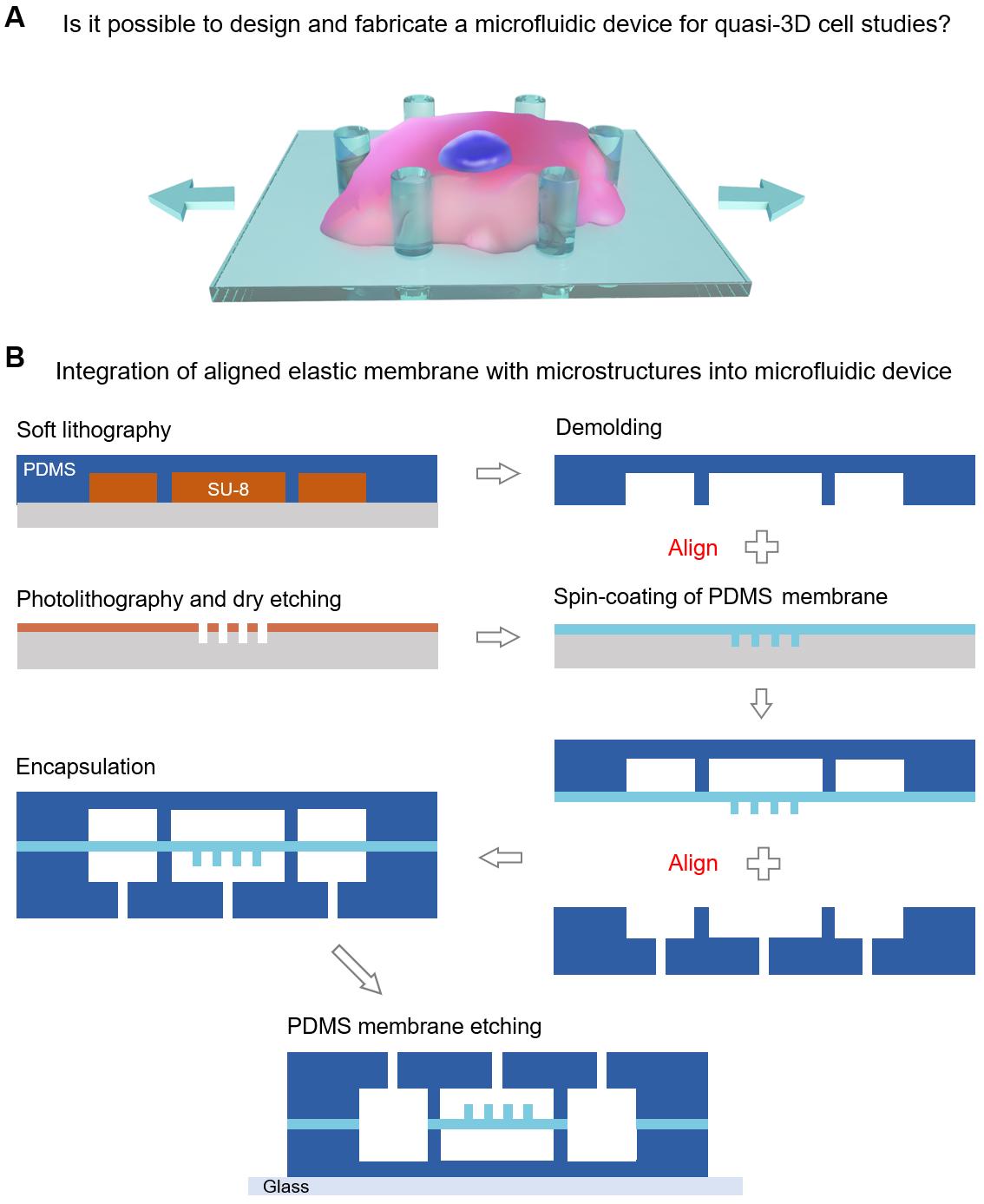
图1. 本研究的基本思路。(A) 细胞响应准三维力学刺激的示意图。(B) 具有拓扑微结构的PDMS膜的制造及组装。 该微流控芯片地制备存在诸多难点:首先,需要进行两次对准;其次,在对准之后还要立即进行等离子体键合以免失活;此外,硅晶片上的微图案通常难以观察清楚,增加了对准难度。为了解决这些问题,研究人员设计并组装了一种新型的芯片快速对准仪(图2)。凭借该对准仪的预对准程序和有效观察的优点,在等离子表面处理后可在1分钟内即可完成对准和键合。
图2. 本研究开发的基于体式显微镜的快速对准系统。(A)三维拆分结构。(B) 快速对准仪的原型机。(C)快速对准仪的使用实例。 图3A显示了键合后的芯片原件。在其右侧显示了微井阵列成功地组装在微通道中间。该操作的技术难点是微井阵列图案(800 μm × 5 mm 的长条)准确地、平行地放置于微通道(1 mm宽)之中。快速对准仪有效地解决了该问题。芯片的横截面如图3B 所示。弹性膜处在上下两个微通道层之间。两个侧腔中的膜通过 PDMS 蚀刻剂去除。由于微通道侧壁约为100 μm宽,且上、下微通道侧壁对齐良好,估计对准精度为 ? 10 μm。图3C 显示了直径为10 μm、25 μm和40 μm三种微井阵列的 SEM 图片。
图3. 微流控芯片的结构表征和微柱阵列。(A) 键合有微井阵列的芯片照片。右图显示微井阵列平行排列在微通道中。(B) 微流控芯片的横截面。右侧是膜上微柱的放大图像。(C) 三种微井阵列的SEM图片,即小微井(S)、中微井(M)和大微井(L)。
活细胞的拉伸和成像系统如图4所示。该系统由压力控制器、注射泵和配备有活细胞培养系统的荧光显微镜组成。通过微柱位移的图像分析可知芯片可在 0-1 Hz 的频率、0-19%拉伸率范围内任意调节。还可在2 Hz的频率、0-13%的拉伸率下正常工作。
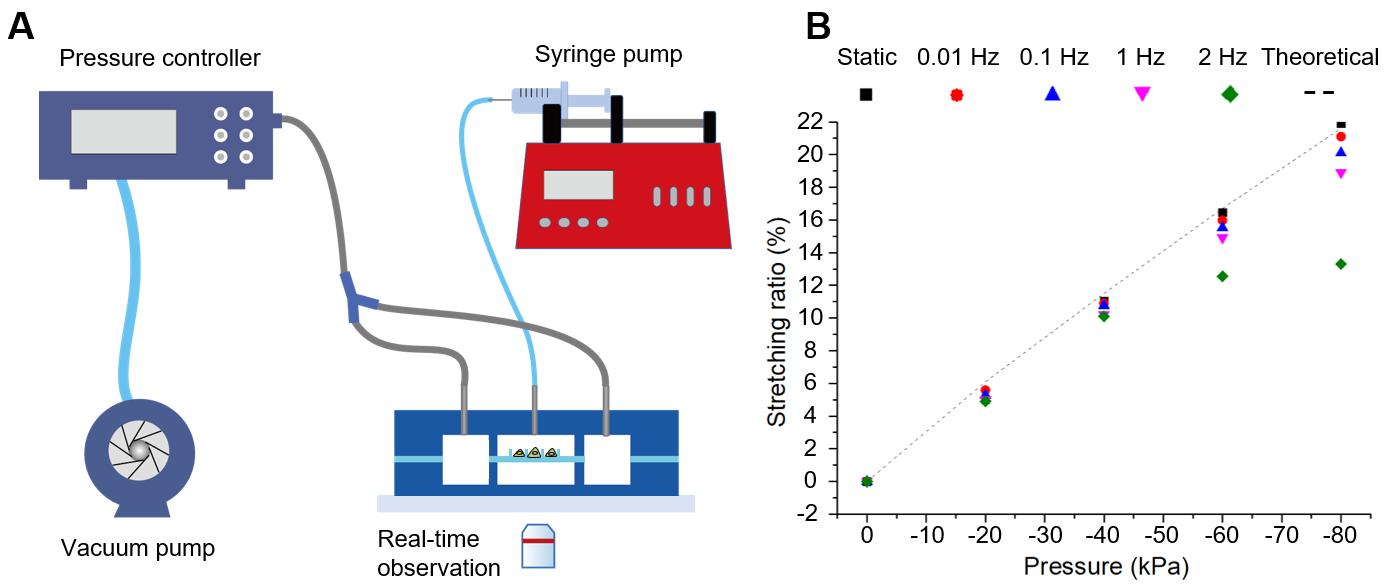
图4 (A) 微流控拉伸系统。(B) 不同拉伸频率下拉伸率与压力的关系。理论结果代表来自有限元分析的静态拉伸率。
研究人员对细胞的“类三维”状态进行详细表征—使用共聚焦显微镜获取原始细胞的三维数据、通过三维重构来数字化显示细胞形态,并使用球形度来估计细胞形状。图5A展示了通过共聚焦显微镜获得的荧光转染活细胞状态。研究人员发现拓扑微结构可以显著地改变细胞形态:在S中,细胞受到严格约束,因此细胞表面粗糙(低球形度);在L中,细胞松散地黏附在微井的底部和侧壁上,呈铺展形态(低球形度);而在M中,细胞适度黏附于微井,因此细胞趋于圆形(高球形度);F上的细胞是四种基板中最平坦的(球形度最低)。球度是用三维重建的数字信息计算的。细胞球度的统计结果分别为0.54(S)、0.65(M)、0.59(L)和0.50(F)。
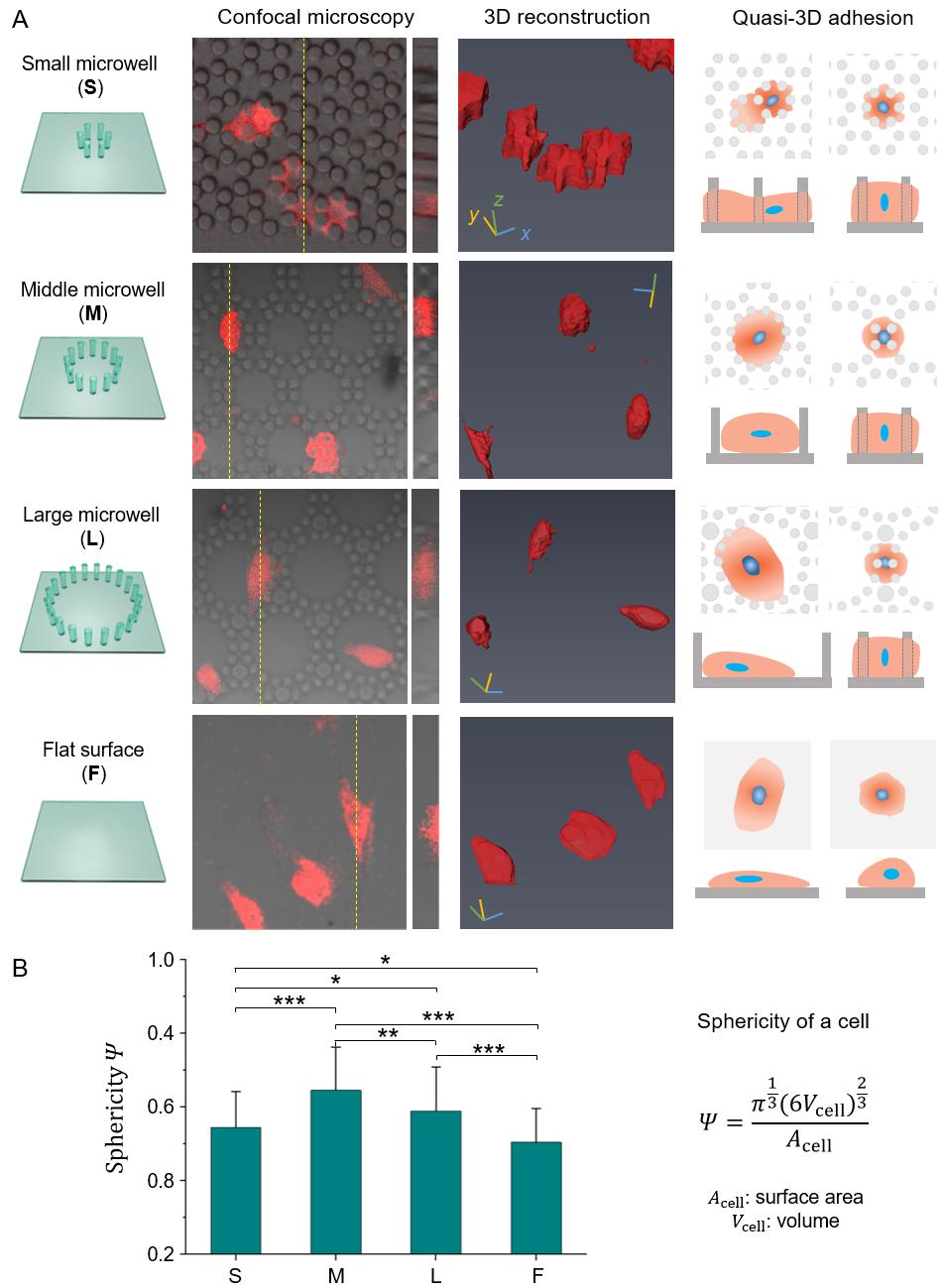
图5. 微柱中 RFP-hMSC 细胞的三维表征。(A) 三种微井阵列 (S、M 和 L)中和平面(F)上的细胞形态。从左到右的四行表示四种基板的示意图、共聚焦显微镜典型结果、三维重构结果、准三维细胞黏附示意图。在共聚焦图片中,红色表示用RFP标记的活细胞,明场表示微柱阵列。(B) 细胞的球度 (n≥80)。 图 6A显示了在循环拉伸(1 Hz,10%)期间,RFP-hMSC细胞的扩散和取向发生了显著变化。图 6B 则显示了细胞铺展和取向随时间变化的统计数据。在拉伸的0-2小时内,细胞在S、M和L阵列中的铺展普遍降低(减少5-8%),而在平面(F)上不明显(减少~1%)。可见,一些细胞选择了收缩成圆形并黏附在微柱的侧壁上以避免物理扰动。在2-10小时内,细胞的铺展达到稳态,铺展率分别为39% (S)、58% (M)、53% (L)和76% (F)。
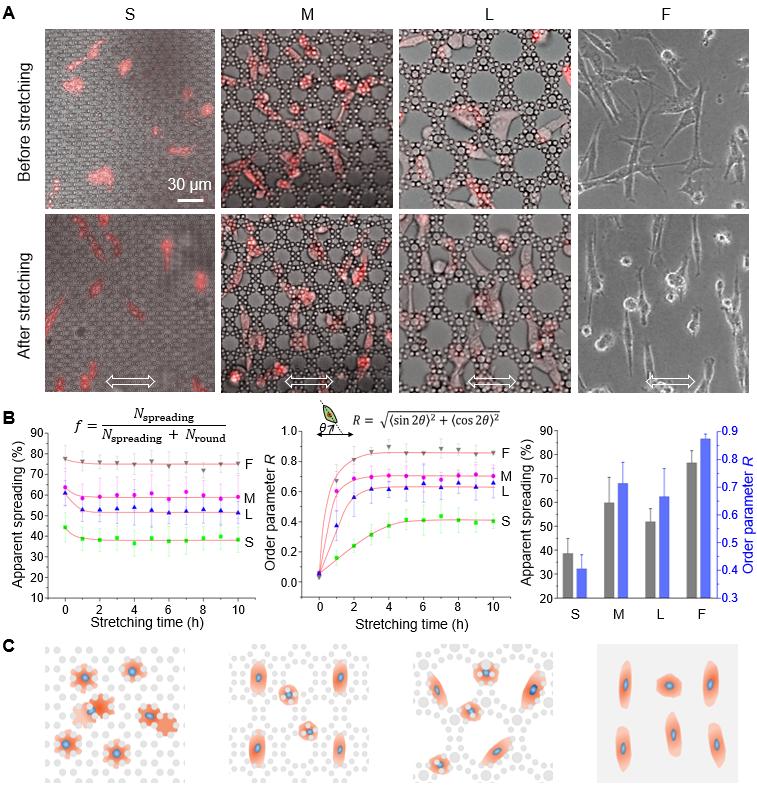
图6. RFP-hMSC细胞在循环拉伸过程中的铺展和取向。 (A)循环拉伸后微井阵列中细胞的显微照片。底部的双箭头表示拉伸方向。荧光模式检测带有RFP(红色荧光)标记的活细胞,相差模式观察微柱阵列;图中所显示的是合并的图像。(B)细胞的表观铺展率和序参量随拉伸时间变化的结果,其中的红线仅用于视觉引导。(C) 循环拉伸的二维或准三维材料微环境中细胞状态的示意图。 拉伸促使细胞迁移发生根本性变化。从图7(上部)显示的单细胞迁移轨迹可以看出,拉伸显著改变了细胞迁移模式。可见在拉伸过程中,细胞感觉到强烈的力学干扰,而为了避免扰动,细胞选择在拉伸的垂直方向上迁移。此外,研究人员用轮廓迁移速度和均方位移 (MSD) 量化了细胞迁移。轮廓迁移速度由迁移长度 ( l ) 除以迁移时间 ( t )得出(详见图7左上角示意图),
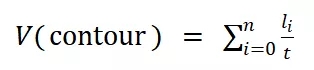 (1)
(1)
MSD 计算公式为
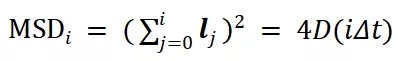 (2)
(2)
或直接通过端到端向量h 计算,
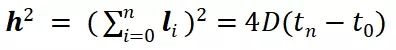 (3)
(3)
其中D是扩散系数。
MSD 随拉伸时间t线性增加。表明细胞迁移遵循粒子布朗运动的随机扩散方程。因此,可以使用 MSD 的结果计算扩散系数D,如图7中部所示。不管是拉伸还是非拉伸情况,微井阵列中细胞的扩散系数大小顺序均为 M > L > S。F的扩散率大于微井阵列,因为细胞可以在没有微柱障碍的情况下迁移。拉伸和非拉伸的扩散系数(D拉伸/ D非拉伸)为 S (0.5) < M (0.9) < L (1.6) < F (5.4),这意味着拉伸使L和F中的细胞迁移速度变快,而是S和M中的细胞较慢。细胞拉伸在很大程度上影响了细胞迁移的方向。众所周知,适度的细胞黏附可以促进细胞迁移。所以对于平坦表面 (F)和稀疏微柱(L)来说,强烈的力学扰动(10% 拉伸 1 Hz)可能会削弱细胞黏附,从而使细胞更适合迁移。至于致密的微柱(S和 M),拉伸可以通过增加细胞牵引力来增强细胞黏附,从而阻碍细胞迁移。
RFP-hMSC细胞在具有不同拓扑形貌表面的轮廓速度为V拉伸= 10 ?m h-1 (S)、29 ?m h-1 (M)、24 ?m h-1 (L)、76 ?m h -1 (F) 和V非拉伸= 14 ?m h-1 (S)、33 ?m h -1 (M)、17 ?m h-1 (L)、35 ?m h-1 (F)。在循环拉伸下细胞迁移显示出很强的方向性。通过计算MSD的X和Y分量(MSD X和MSD Y ),并将 MSD Y / MSD X定义为方向性,数值为 1.4 (S)、5.1 (M)、3.8 (L) 和 17.2 (F)。
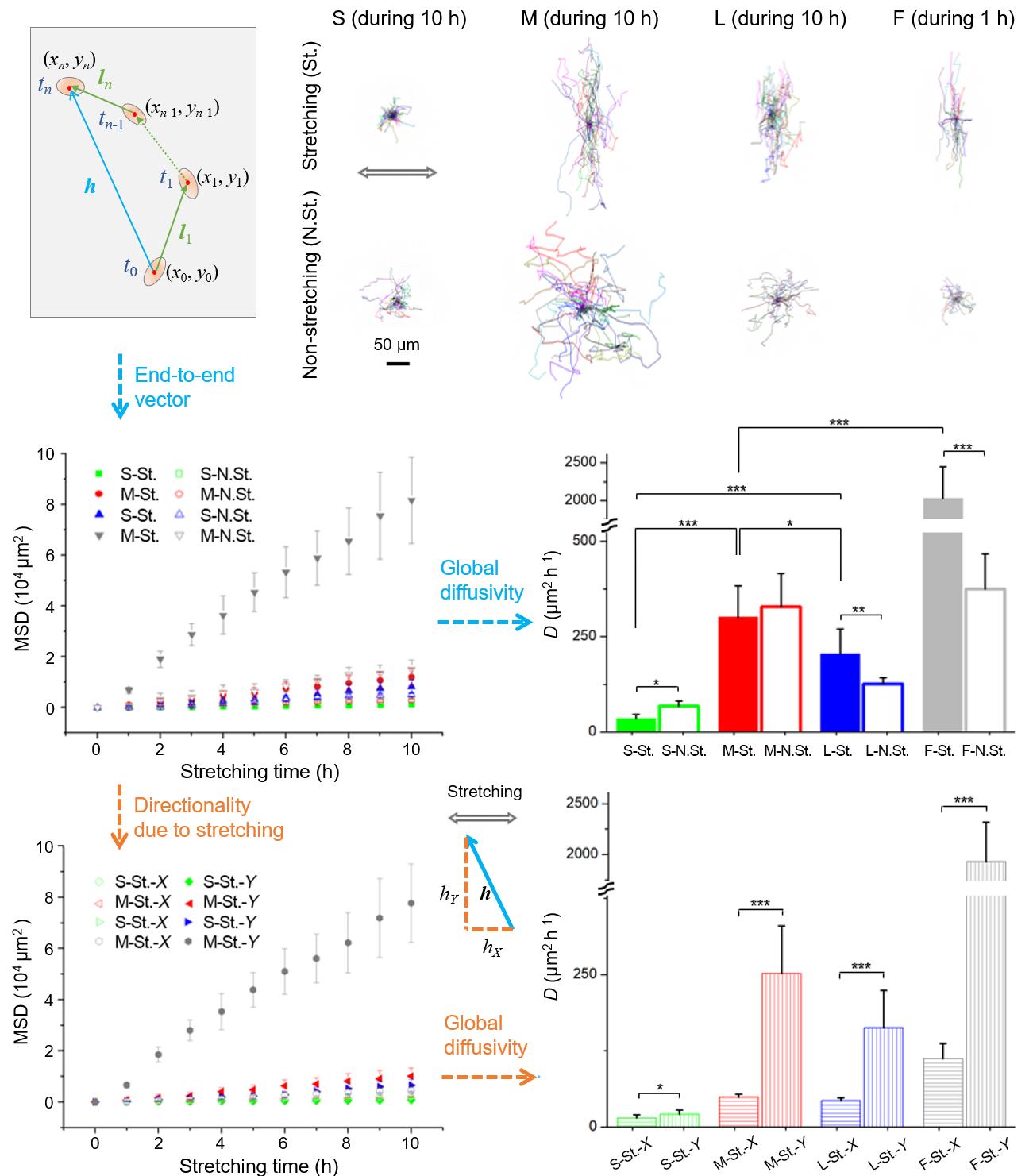
图7. 循环拉伸 (St.) 和非拉伸 (N.St.) 下单个细胞的跟踪路径。图中显示了每个基板的30个细胞轨迹。MSD是根据每1小时迁移轨迹的端到端距离计算得出的。MSD的X和Y分量用于计算迁移的方向性。
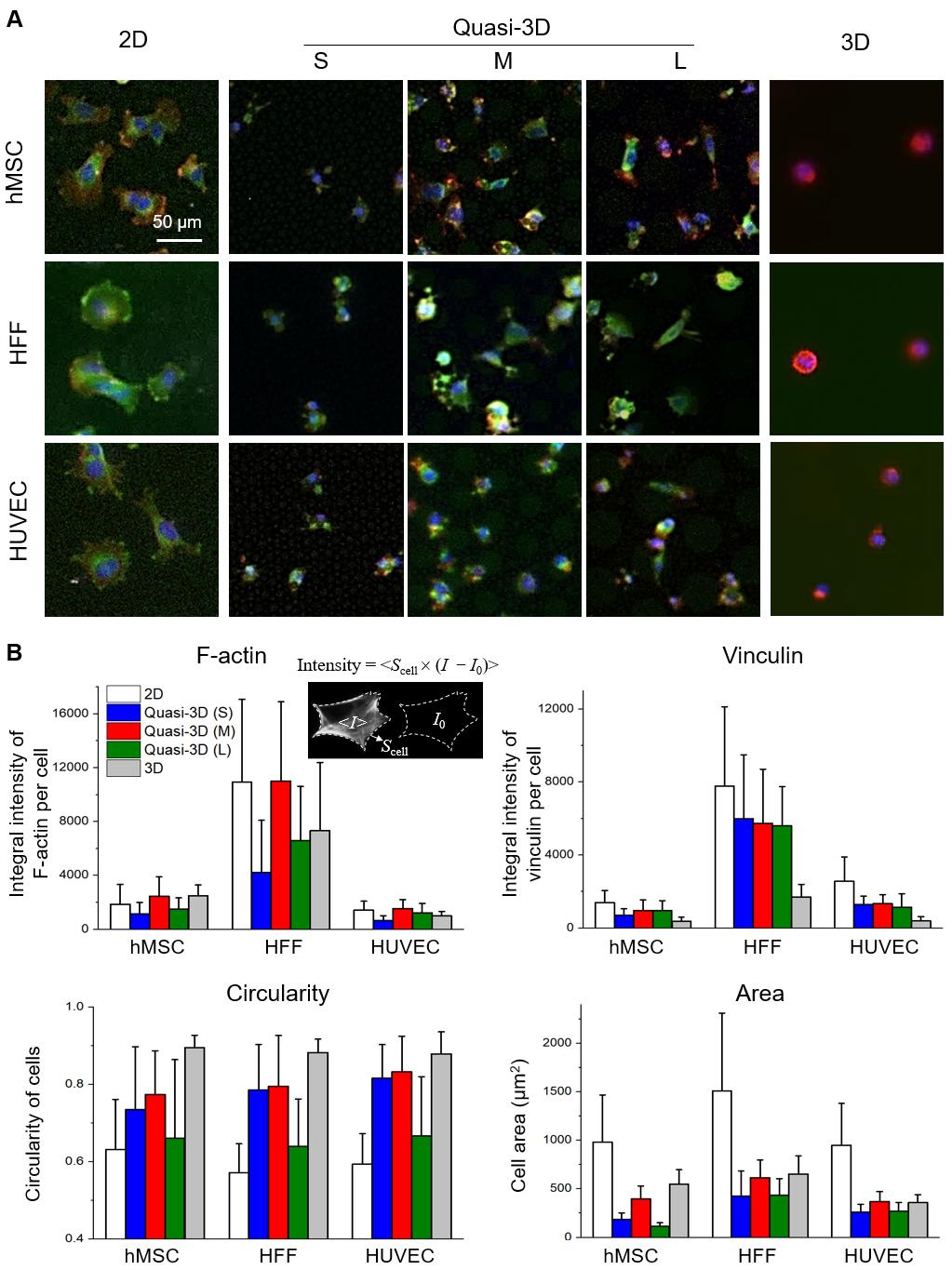
为了清楚地表征细胞与材料之间的相互联系,研究人员将hMSC细胞培养在二维(在平面PDMS上)、准三维(在PDMS微井中)和三维(在 Matrigel)微环境中。固定染色后,在共聚焦显微镜下逐层扫描细胞。结果如图8所示:黏着斑蛋白(vinculin)和微丝(F-actin)在所有维度中都很显著,这说明细胞与材料之间存在明显的黏附位点。其中研究人员发现,在三维微环境中的黏着斑蛋白的荧光强度相对较弱,这可能是由于细胞与软水凝胶的黏附较弱引起的。
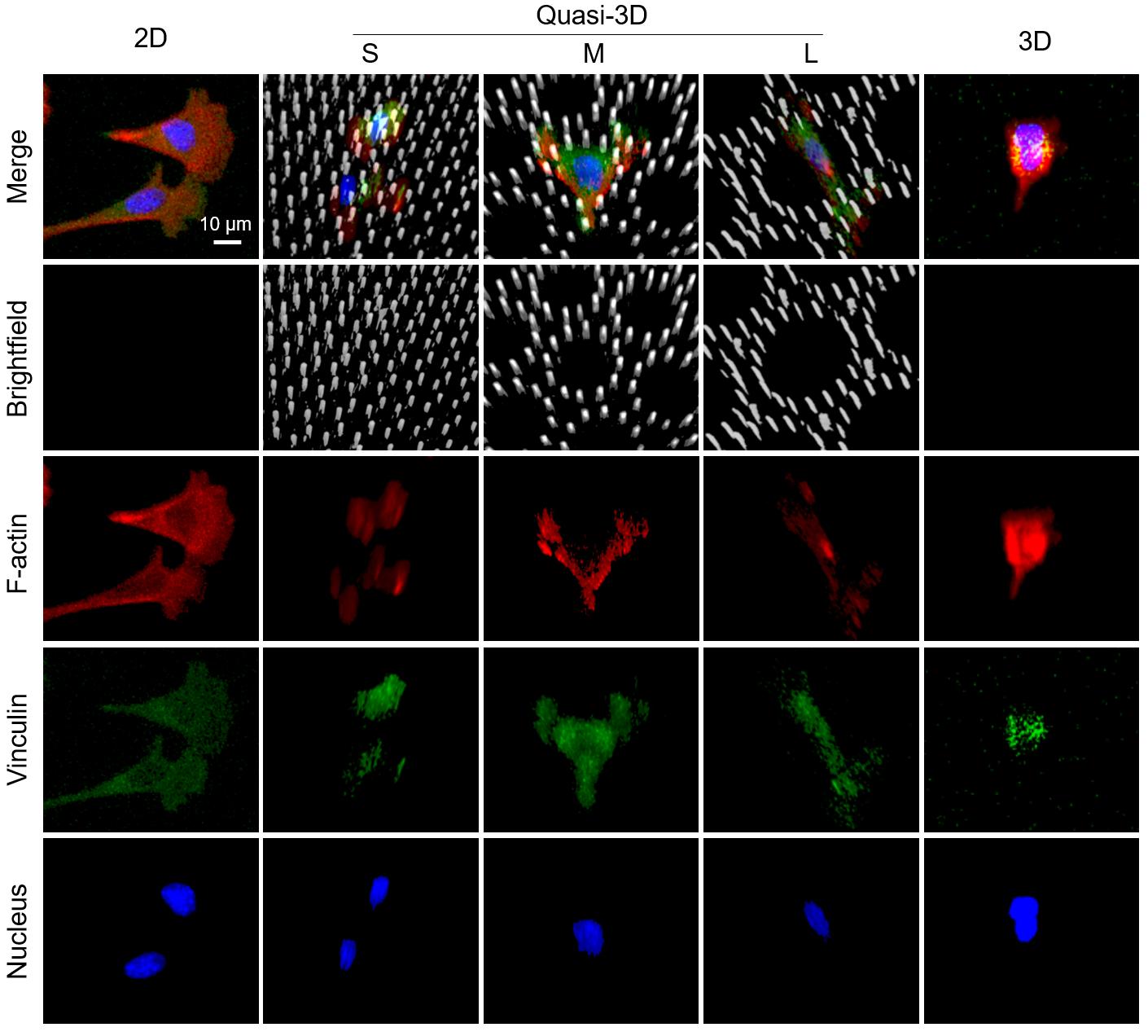
图8. 共聚焦显微镜Z轴层扫的三维叠加图。其中灰色表示材料;红色表示微丝;绿色表示黏着斑蛋白;蓝色表示细胞核。此处,“2D”表示平坦 PDMS 表面上的细胞,“3D”表示基质胶中的细胞,“quasi-3D”表示被PDMS微柱包围的微井中的细胞,其中“S”、“M”和“L”表示小、中、大微井。 细胞在二维和准三维中培养4 h,在三维中培养24 h。 为了考察不同细胞对于三种微环境的响应,将三种细胞在二维、准三维和三维微环境中的细胞响应。这三种细胞分别为hMSC(人骨髓间充质干细胞)、HFF(人包皮成纤维细胞)、HUVEC(人脐静脉内皮细胞)。需要强调的是,这里并没有动用循环拉伸。图9A所示,细胞在二维微环境中4 h内就铺展良好。但在三维微环境中尽管培养24 h,细胞仍然在基质胶中趋于圆形。在准三维微环境中,细胞表现出不同的形态:M使细胞比S和L膜更圆。图9B显示了定量分析的结果。圆度确实是二维<准三维<三维。此外,每个细胞中黏着斑蛋白的积分强度为二维: 准三维:三维= 5:3:1。因此,准三维微环境介于二维和三维之间,且相对更接近三维。在准三维(S、M 和 L)中,M组在所有三类细胞的三个方面(微丝、圆度和细胞面积)均显示出最高值。
图9. 在二维(PDMS平面上)、准三维(PDMS 微井中)和三维(基质胶中)微环境中培养的不同类型的细胞。(A) 染色的hMSC、HFF和HUVEC 的荧光显微照片,其中微丝为红色,黏着斑蛋白为绿色,细胞核为蓝色。(B)二维和准三维细胞培养 4 h,三维细胞培养 24 h后微丝和黏着斑蛋白的积分强度和细胞黏附参数的统计结果。
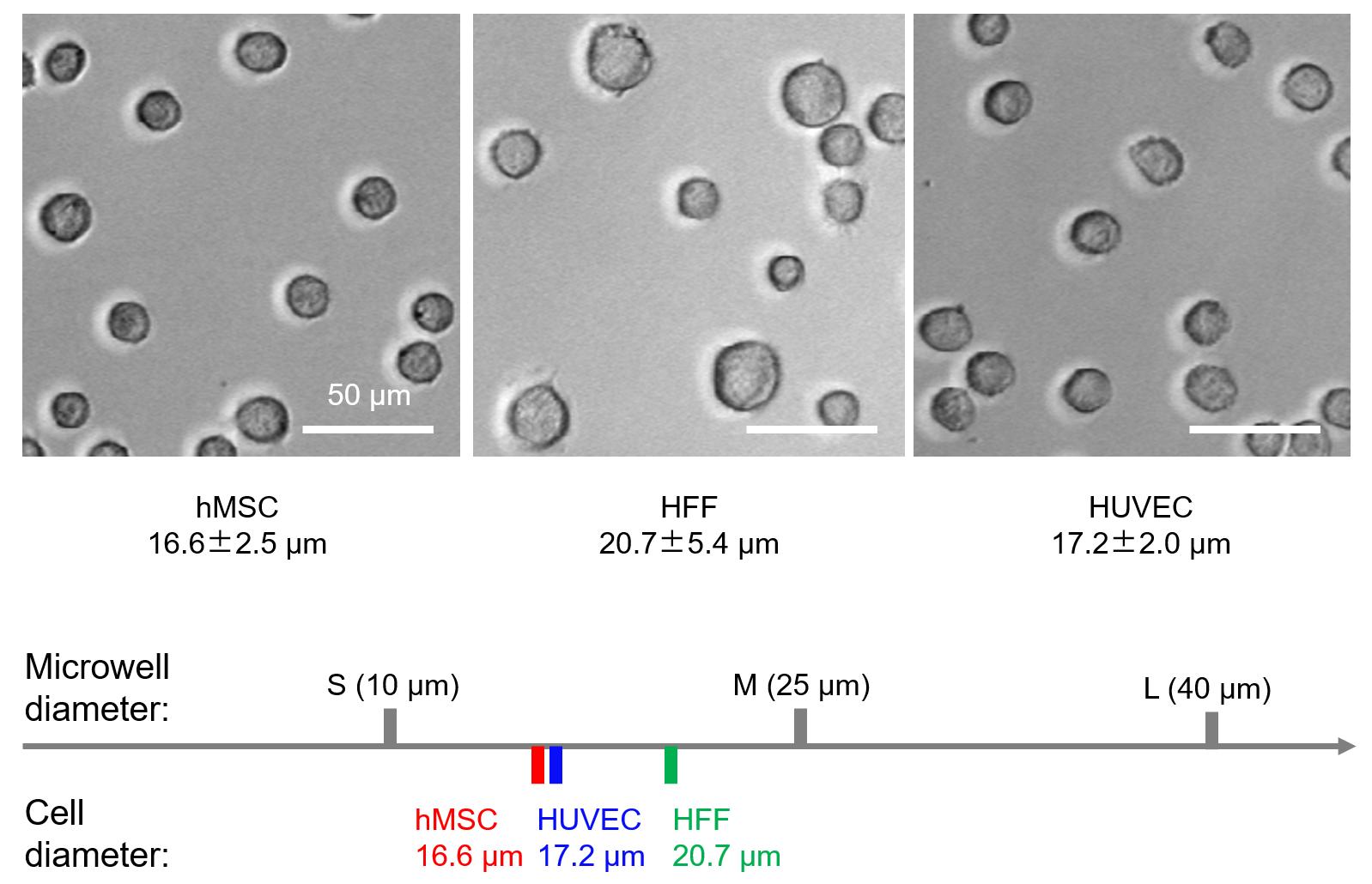
通过以上研究发现,细胞在中等微井(M)中的取向、铺展、迁移均比小微井 (S) 和大微井 (L)高。由于细胞球度的顺序为 M > L > S,研究人员推测准三维细胞黏附改变了细胞行为。也就是说,M可能充当“适度支架”来帮助细胞黏附、重新定向和迁移。为了进一步阐明“适度支架”这一概念,研究人员将三种细胞用胰酶消化之后重悬于组织培养板 (TCP) 表面20 分钟进行拍摄,获得清晰的细胞显微镜照片。经过细胞尺寸统计,研究人员得到hMSC、HFF和HUVEC细胞的直径分别为16.6?2.5 μm、20.7?5.4 μm、17.2?2.0 μm。这三种人源细胞的尺寸确实均落在S微井和M微井的直径范围内,因此三种类型的细胞均能在进入中微井后感应到适当的准三维微环境。